背景及概述
芳基硼酸是中等强度的路易斯酸,反应活性平稳,化学性质比较稳定,是一种重要的中间体,已在医药、农药、生物活性试剂和有机发光材料等制备中得到了广泛的应用。自从1981年Suzuki偶联反应发现以来,有机硼酸已经作为传统金属有机试剂的替代品应用于一系列有机合成反应中,如过渡金属催化的芳基硼酸与酚类化合物的反应、芳基硼酸与芳胺类化合物的反应、芳基硼酸与醛酮化合物、亚胺化合物的加成、芳基硼酸参与的Mannich反应等。近年来。9-菲硼酸作为一种稠环芳基硼酸,在有机电致发光材料的制备、医药以及生化检测领域中得到比较广泛的应用。
制备
目前文献报道主要集中于它的应用,对它的合成报道很少。本文在传统的格氏试剂法合成芳硼酸的基础上,通过对合成条件的优化,采用“一锅法”来制备9-菲硼酸,简化了合成方法,提高了反应的收率,有利于实现工业化生产[1]。
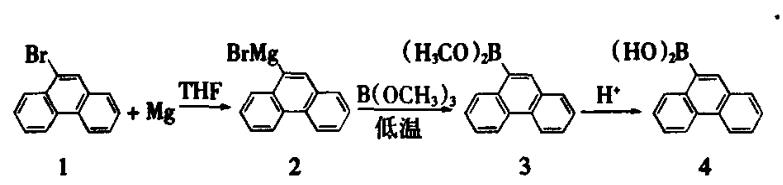
图1 9-菲硼酸合成反应式
实验操作:
格氏试剂的制备
在氮气保护下,在250ml三口圆底烧瓶中加入1.32 g(0.055 mol)新鲜的镁屑;通过恒压滴液漏斗,将溶解12.85 g 9-溴菲(0.05 mol)的100 mL无水四氢呋喃缓慢滴加到烧瓶中,先滴加20滴,加入1~2滴1,2-二溴乙烷,加热,反应引发后,反应液温度升高,混合液颜色变为褐色,搅拌,继续滴加剩余的9-溴菲与无水四氢呋喃混合溶液;调节滴加速度,保持反应液轻微回流,约1 h滴加完毕;继续搅拌1 h,至镁屑全部消失;得到化合物为9-溴菲格氏试剂的溶液(反应式中化合物2),直接进入下一步反应。
9-菲硼酸的合成
将制得的9-溴菲格氏试剂(2)置于-40℃低温浴中,将7.79 g(0.075 mol)B(OCH3)3滴加到(2)中,约10min滴加完毕;反应液颜色变为白色,继续在低温浴中搅拌反应1 h,然后移出低温浴,使反应混合液温度自然升至室温,缓慢加入50mL浓度为4%的盐酸;搅拌调节pH值为酸性,通过旋转蒸发器,除去溶剂,得到9-菲硼酸粗品(4),然后用苯或者石油醚洗涤,过滤干燥至恒重得白色粉末状固体7.91 g,收率71.24%。测定其熔点为168℃(文献值为165-170℃)。
结构确证
红外光谱分析
采用溴化钾压片法。对得到产品的结构进行了红外光谱分析。红外谱图表明,1385.42-1623.12cm-1出现6个吸收带。归属为苯环上C=C双键的伸缩振动;3348.09cm-1出现的较宽吸收蜂归属为成氢键的-OH键的伸缩振动;1385.42 cm-1处出现的吸收峰归属于B-O键的伸缩振动;544.46~731.13 cm-1间出现吸收峰,归属为B-C键的振动。与9-菲硼酸的标准谱图一致。
核磁谱分析
采用Bruker-AV300型核磁共振仪(1H NMR)对目的产品的结构进行了分析。从1H NMR谱图中可以看出,除了位于2.500ppm处的溶剂DMSO峰外,8.77-8.82(m,2H)是羟基上的氢,是7.59-8.44(m,9H)是菲环上的氢。
结果与讨论
本文主要对亲核取代温度、反应物配比以及溶剂用量等主要影响因素进行了考察,来优化9-菲硼酸的合成条件。9-菲硼酸的收率随亲核取代温度的升高而下降。这是由于亲核取代温度的升高,促使副反应发生的缘故。格氏试剂主要进攻三烷基硼酸酯中的一个烷基,此外格氏试剂可以继续进攻一取代产物中的硼原子,从而生成二取代、甚至三取代产物。二取代和三取代产物往往是不需要的副产物。低温可以降低反应物的活性,从而可以抑制二取代或i取代副反应,明显提高收率。低温反应有利于芳基硼酸的形成,选用-40℃作为亲核反应温度较为适宜。
结论
以9-溴菲为原料,格氏试剂法合成9-菲硼酸的条件为:亲核取代温度为-40℃,9-溴菲(g):THF(mL)的反应配比为1:7.5、反应物摩尔比为n(Mg):n(9-溴菲):n(B(OCH3)3)=1.1:1:1.5、硼酸三甲酯作为硼化试剂。9-菲硼酸的收率可达71.24%,纯度可达99%。
参考文献
[1] New Journal of Chemistry, , vol. 32, # 11 p. 1847 - 1849
